Verdünnungsrechnen
Hallo Zusammen, ich hätte folgende Aufgabe und würde gerne wissen ob ich das so richtig gerechnet habe :)
Eine 40%ige Lösung soll auf 5% verdünnt werden. Wie viel benötigen Sie jeweils wenn 5 Liter der Lösung hergestellt werden sollen?
Ich würde folgendermaßen vorgehen:
5% von 5000mL = 250 mL
250mL : 0,4 = 625 mL
Folglich würde ich, um 5 Liter der Lösung herzustellen, 625 mL Lösung mit 4375 mL Wasser mischen.
Ist das so korrekt??
4 Antworten

Fast richtig.
Folglich würde ich, um 5 Liter der Lösung herzustellen, 625 mL Lösung
Bis dahin stimmt alles. In den 625 ml Lösung ist soviel Stoff drin, wie Du für 5 l der gewünschten Konzentration benötigst.
mit 4375 mL Wasser mischen.
Das kommt nur ungefähr hin. Du mußt auf 5 l auffüllen, wieviel ml Wasser Du dafür benötigst ist stoffabhängig. Schau Dir mal http://de.wikipedia.org/wiki/Exzessvolumen an.

% bedeutet g Substanz je 100 g Gemisch (Gew.-%), es sei denn, Du hast vergessen Vol.-% hinzuschreiben. Bei Vol.-% kannst Du genau so verfahren, wie Du es beschrieben hast. Handelt es sich jedoch um Gew.-%, mußt Du die Dichte der 40 %igen und der 5 %igen Lösung berücksichtigen.
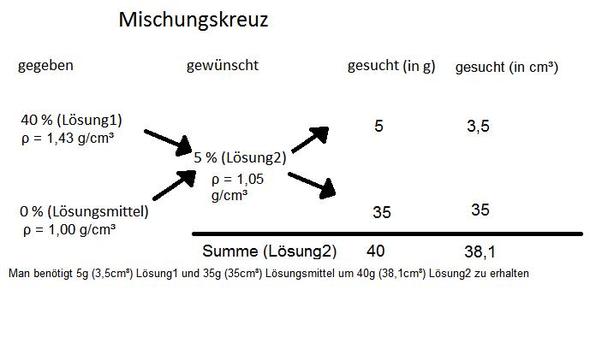

Was jetzt, Mathematik oder Chemie?
Wenn das eine Aufgabe in Mathematik ist, Thema Prozentrechnen, dann ist Deine Vorgehensweise richtig.
Wenn es eine Aufgabe in Chemie ist, muss zwischen Volumenprozent (üblich vor allem bei alkoholischen Getränken) und Gewichtsprozent (fast alles andere) unterschieden werden.
Für Volumenprozent gilt die Antwort von cg1967, für Gewichtsprozent die von IMThomas.

und für die Massenkonzentration
Stimmt, aber die war nicht gefragt, da sie nicht in % angegeben wird. Ausser in der im medizinischen Bereich manchmal noch verwendeten ominösen Einheit "mg%" (Kurzform für mg pro 100ml).
Angaben in Gewichtsprozent kommen im Labor dagegen weiterhin vor, üblicherweise steht auf der Flasche 96% H2SO4 und nicht 1750 g/l und auch nicht 18 mol/l

Stimmt genau!

und für die Massenkonzentration, welche im Labor die interessante Größe ist (egal, ob sie in % oder in g/l oder als Stoffmengenkonzentration in mol/l angegeben ist). Bei einer Flüssigkeit mißt man Volumina und keine Massen, will aber aus dem Meßergebnis direkt (ohne Umweg über die Dichte) auf die Masse und somit die Stoffmenge des gelösten Stoffes schließen können.